CDG: GLS1-CDG 

Inleiding
De Belgische kinderarts professor Jaeken, was de eerste die twee kinderen met CDG beschreef, in 1978. Zijn patiëntjes leden aan de variant PMM2-CDG, die ook wel het syndroom van Jaeken wordt genoemd naar de ontdekker ervan. Dit is de meest voorkomende vorm van CDG.
Glycoproteinen
Glycosylering is een proces in de cel waarbij suikerketens, glycanen, worden gevormd en vervolgens aan een eiwit worden verbonden. De stoffen die zo ontstaan zijn glycoproteinen. Glycoproteïnen hebben verschillende functies in het lichaam. Sommige vervullen de functie van hormonen, andere zijn nodig voor de bloedstolling, het afweersysteem of voor transporten.
Glycosylering gebeurt op speciale plaatsen binnen de cel. Het grootste deel van het glycosyleringsproces speelt zich af in het Endoplasmatisch Reticulum en in het Golgi-apparaat. Dat zijn kleine onderdeeltjes van de cel, waarin eiwitten als het ware worden ‘aangekleed’: stap voor stap worden er suikerketens opgebouwd en aan het eiwit geplakt. Er zijn meer dan honderd verschillende enzymen bij de vorming van glycoproteïnen betrokken. Als door een aangeboren afwijking, één van die enzymen niet werkt of niet aanwezig is in het lichaam van een patiënt, kunnen de glycoproteïnen niet op de juiste manier gemaakt worden. Er worden dan bijvoorbeeld veel te weinig suikerketens aan het glycoproteïne geplakt. Daardoor kunnen de glycoproteïnen hun functie in het lichaam niet goed uitvoeren. Bij zulke defecten, spreken we van CDG.
Omdat glycoproteïnen op zoveel plaatsen in het lichaam een belangrijke functie hebben, zorgt een fout in de productie van glycoproteïnen ervoor dat veel verschillende organen op de een of andere manier problemen hebben. CDG is dan ook een ziekte die in de meeste gevallen invloed heeft op het hele lichaam.
Veel verschillende vormen van CDG
Tot dusver zijn bijna 50 varianten van deze ziekte geïdentificeerd waarvan de meeste zeer zeldzaam zijn. In deze tekst zullen algemene kenmerken van CDG beschreven worden. Er wordt nog een specifieke beschrijving gemaakt.
Het defecte of ontbrekende enzym
Bij elk type CDG is een ander enzym in de glycosylering niet of minder goed werkzaam. Doordat continu onderzoek wordt gedaan naar de ziekte, komen er steeds nieuwe enzymdefecten bij.
Zeldzaamheid
Het CDG syndroom is zeldzaam. De CDG-1a (PMM2-CDG) variant komt relatief het meest voor. Op de hele wereld zijn van die variant zo’n 300-400 patiënten bekend. Voor de andere varianten is dit aantal vele malen kleiner: van één tot maximaal dertig patiënten over de hele wereld. Daarnaast zijn er enkele patiënten met een nog onopgehelderde variant van CDG. Deze worden geplaatst onder de noemer CDG-x.
Symptomen
Omdat er zoveel verschillende varianten zijn van het CDG-syndroom, is het moeilijk om te spreken van typische symptomen die voor alle varianten gelden. Wel is het zo dat bij vrijwel alle varianten (behalve bij MPI-CDG) neurologische problemen voorkomen. Vaak betekent dit dat de patiënt een ontwikkelingsachterstand heeft, al of niet in combinatie met epilepsie. De ernst van de ontwikkelingsachterstand en de epilepsie kunnen verschillen per patiënt.
De hieronder besproken symptomen kunnen bij CDG-patiënten voorkomen.
Uiterlijke symptomen
Een typisch uiterlijk kenmerk dat met name bij CDG-1a vaak voorkomt, zijn de ingetrokken tepels. Ook typisch voor CDG zijn afwijkende vetophopingen rond de billen en een huid die deegachtig aanvoelt. Daarnaast komt het voor dat patiëntjes afwijkend gevormd hoofd en een afwijkende stand van de ogen hebben. Sommige patiënten zien scheel, andere hebben wijd uiteen staande ogen. Bij veel CDG-varianten hebben patiëntjes een klein of smal hoofd, maar een opvallend brede schedel komt ook voor, vaak in combinatie met een brede neusbrug en een grote mond en oren.

Lichamelijke kenmerken
Bij vrijwel alle CDG-varianten hebben patiënten een achterstand in de verstandelijke en motorische ontwikkeling. Daarnaast hebben ze vaak erg slappe spieren en coördinatiestoornissen en evenwichtsstoornissen. Niet alleen de spieren, maar ook de botten kunnen zijn aangedaan bij CDG-patiënten. Vaak lijdt dit tot problemen als veelvuldige botbreuken en vergroeiingen.
Patiënten kunnen afwijkingen hebben aan hun hart en organen zoals de lever en de schildklier of de nieren. Deze afwijkingen kunnen ervoor zorgen dat kinderen al op jonge leeftijd komen te overlijden.
Veel CDG-patiënten hebben problemen met eten. Daardoor groeien ze slecht en kunnen ze last krijgen van gevaarlijk lage bloedsuikers. Een neus-maagsonde kan in zo’n geval zorgen dat het kind toch voldoende voedingsstoffen binnenkrijgt.
Stollingsproblemen en lage bloedplaatjes zijn bekende tekenen van het CDG-syndroom.
Ook oogproblemen komen bij CDG-patiënten vaak voor. Behalve van scheelzien, hebben patiënten vaak ook last van een langzaam verminderend zicht door pigment op hun netvlies.
Diagnose
Er is een laboratoriumtest waarmee patiënten kunnen worden gescreend op CDG-defecten. In die test wordt het bloed onderzocht op transferrine, een glycoproteïne. De test laat zien of het transferrine normaal gevormd is, of dat er afwijkingen zijn in de suikerketens van het transferrine. Als het transferrine afwijkend is, is dat een aanwijzing dat de patiënt één van de varianten van CDG heeft. Uit het testresultaat is echter niet af te lezen welke variant de patiënt heeft. Bovendien kan de transferrinetest ook een afwijkende uitslag geven bij sommige andere stofwisselingsziekten. Daarom is het vrijwel altijd nodig om vervolgonderzoeken te doen. Daarvoor wordt vaak extra bloed afgenomen, of een stukje huid.
Met de extra laboratoriumonderzoeken is het voor artsen mogelijk om het precieze enzymdefect aan te wijzen dat de ziekte van de patiënt veroorzaakt. Dat is niet alleen nodig om de diagnose met zekerheid te kunnen stellen, maar is ook belangrijk als de ouders van de patiënt graag nog meer kinderen willen krijgen.
Wanneer screenen op CDG?
Patiënten met CDG hebben soms zulke uiteenlopende symptomen, dat het moeilijk is om te bepalen of een transferrinetest zinvol is. Over het algemeen zullen artsen een transferrinetest doen als de patiënt een onverklaarbare verstandelijke of motorische ontwikkelingsachterstand heeft, in combinatie met één of meerdere orgaanproblemen.
Omdat CDG erg zeldzaam is, kan het soms moeilijk zijn om de juiste diagnose te vinden. Toch zijn er steeds meer artsen die wel eens van deze groep van ziekten gehoord hebben. Daardoor zijn er in de laatste jaren veel meer patiënten gediagnosticeerd en zijn er verschillende nieuwe varianten van de ziekte ontdekt.
Prenatale diagnostiek
Omdat er zoveel verschillende soorten CDG zijn, is prenatale diagnostiek alléén mogelijk als het precieze enzymdefect van een patiënt bekend is. Alleen dan kunnen ouders bij een volgende zwangerschap laten testen of het ongeboren kindje de ziekte ook heeft.
Behandeling
Géén van de varianten van CDG is te genezen. De enige vorm van CDG waarvoor momenteel een effectieve behandeling bestaat, is CDG-1b (MPI-CDG). Patiënten met CDG-1b (MPI-CDG) krijgen mannose als medicijn. Daarmee wordt het enzymdefect dat voor hun klachten zorgt, omzeild.
Voor de andere varianten van CDG is het alleen mogelijk om met verschillende behandelingen de symptomen van de ziekte zoveel mogelijk te verlichten. Zo kan een kind een neus-maagsonde krijgen als het veel moeite heeft met eten. Ook wordt vaak uit voorzorg antibiotica gegeven, om infecties te voorkomen. Het is van belang dat CDG-patiëntjes regelmatig onder controle blijven van een kinderarts metabole ziekten, zodat eventuele problemen vroegtijdig kunnen worden ontdekt.
Hoewel de ondersteunende behandelingsmogelijkheden de overlevingskansen van CDG-patiënten vergroten, overlijdt ongeveer twintig procent van de kinderen in de eerste levensjaren. Vaak komt dat door een ernstige infectie of door problemen met de lever of het hart. Kinderen die de moeilijke eerste levensjaren hebben overleefd, hebben over het algemeen een goede levensverwachting, alhoewel het moeilijk is om die precies in te schatten.
Erfelijkheid
Stofwisselingsziekten zijn erfelijke ziekten. Meestal wordt dan gedacht aan ziekten of eigenschappen die al generaties ‘in de familie’ zitten, maar dat hoeft niet altijd zo te zijn. We proberen het zo duidelijk mogelijk uit te leggen.
Het menselijk lichaam bestaat uit allemaal cellen. In de kern van iedere cel zitten chromosomen. Chromosomen zijn strengen erfelijk materiaal. Ze bestaan uit een stof die we DNA noemen. In dit DNA zit een soort ‘code’ waarin al onze erfelijke eigenschappen zijn vastgelegd. Het DNA is er in tweevoud: de ene helft van het DNA komt van de vader en de andere helft van de moeder.
Normaal gesproken zijn er per cel 22 gelijke chromosoomparen (autosomen). Het 23e paar is geslachtsbepalend en dus verschillend bij mannen en vrouwen: een vrouw heeft twee X-chromosomen en een man heeft een X- en een Y-chromosoom. Een man erft het Y-chromosoom altijd van zijn vader en het X-chromosoom van zijn moeder. Een vrouw krijgt van haar vader én van haar moeder een X-chromosoom.
Op de chromosomen zitten de genen. Een gen is een stukje DNA. Elk gen beschrijft de code van één erfelijke eigenschap. Bijvoorbeeld hoe je eruitziet en hoe je lichaam werkt. Van elk gen zijn er twee kopieën: één afkomstig van de moeder, één afkomstig van de vader. Als er een verandering in een gen optreedt, heet dat een mutatie.
Autosomaal recessief
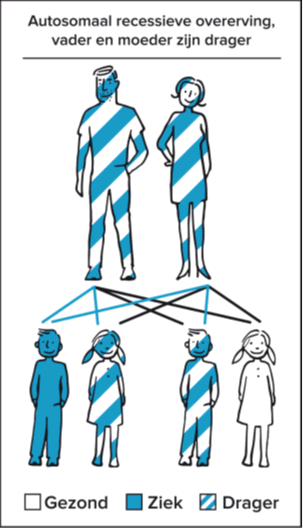
Deze stofwisselingsziekte erft ‘autosomaal recessief’ over. Autosomaal betekent dat het afwijkende gen (het gen met de mutatie) niet op de geslachtschromosomen X en Y ligt maar op één van de 22 gewone chromosomen. Zowel jongens als meisjes kunnen de aandoening dan krijgen. Ook is de kopie van het gen op het ene chromosoom zwakker dan de functionerende kopie van het gen op het andere chromosoom. Dit wordt bedoeld met de term recessief. Dit betekent meestal dat dragers van één afwijkend gen daarvan geen klachten hebben, omdat het functionerende gen op het andere chromosoom wel werkt en de taak van de afwijkende kopie compenseert.
Om ziekteverschijnselen te hebben zijn er dus twee afwijkende genen nodig. Iemand met een autosomaal recessief overervende stofwisselingsziekte heeft van allebei de ouders precies het afwijkende deel van het gen geërfd. Bij deze persoon zorgt deze combinatie voor een genetische code die niet werkt. Hierdoor kan één enzym of eiwit niet of niet voldoende worden gemaakt. Dat zorgt voor de ziekteverschijnselen.
Dragerschap en overerving
In de meeste gevallen hebben beide ouders nergens last van. Zij zijn dan gezonde dragers. Het functionerende gen op het andere chromosoom zorgt ervoor dat het benodigde enzym of eiwit bij hen voldoende wordt aangemaakt. Elk mens heeft ongeveer 25.000 genen. En elk mens draagt meerdere recessief afwijkende genen met zich mee en merkt daar meestal helemaal niets van. De variatie in onze genen, inclusief de recessieve afwijkingen, maken ons tot unieke individuen. Maar zorgen er dus ook voor dat er ineens een kind kan worden geboren met een erfelijke aandoening. Zonder dat die aandoening in de familie voorkomt. Zonder dat ouders wisten dat zij drager waren.
Als we weten dat beide ouders drager zijn van hetzelfde afwijkende gen, weten we dat ze bij elke zwangerschap een kans van 1 op 4 (25%) hebben op een kind met de ziekte. Ook hebben ze een kans van 3 op 4 (75%) op een kind dat niet ziek is. Van de gezonde kinderen zal 2/3, net als de ouders, gezonde drager zijn. Deze kinderen kunnen de ziekte alleen doorgeven als hun partner ook dezelfde afwijking heeft op zijn of haar DNA.
Overige informatie
Omim nummer
Synoniemen:
Congenital disorder of glycosylation, type 2b
CDG-2b
Glucosidase deficiency / deficiëntie
Carbohydrate-deficient glycoprotein syndrome, type 2b
Meest gebruikte naamCDG GLS1-CDG
Kenniskaarten:
Informatie voor kinderen:
Zijn er leden met deze ziekte?
Er zijn momenteel geen leden met ‘CDG: GLS1-CDG’ bij ons aangemeld.
Datum laatst bewerkt:
02 August 2021
Autorisatie door:
dr. R.A. Wevers, dr. E. Morava
Disclaimer
Aan de ziekte-informatie kunnen geen rechten worden ontleend. De informatie is mogelijk niet op alle punten actueel, omdat de ontwikkelingen en inzichten snel kunnen gaan. VKS tracht de ziekte-informatie zo goed mogelijk actueel te houden.
Ervaringsverhalen zijn persoonlijke verhalen. De beschrijving van de ziekte en symptomen gelden voor deze persoon. Zoals voor veel erfelijke ziekten geldt, is er een behoorlijke variatie in ernst onder de patiënten. U kunt uit dit verhaal dan ook geen algemene conclusies trekken. Het verhaal geeft slechts een beeld hoe het leven met deze stofwisselingsziekte in de praktijk eruit kan zien.
Heeft u hulp nodig bij het inloggen?
Vond u deze informatie nuttig? Help ons dan om dit in stand te houden.
Een groot aantal van de lemma's in deze verklarende woordenlijst is samengesteld door Barbara Trimbos-Hart, eigenaar/beheerder van http://www.mitoinfo.nl, site voor en door volwassenen met een mitochondriële aandoening.
Wilt u zelf een woord toevoegen? Mail dan term en omschrijving naar info@stofwisselingsziekten.nl
A- voor een woord betekent niet aanwezig, bijvoorbeeld a-typisch.
Aanpassingen Dagelijks Leven, zelfredzaamheid. Toepassingen van functies en vaardigheden bij bijvoorbeeld: voortbewegen, eten en drinken, wassen, aan- en uitkleden, toiletgebruik etc.
Vanaf de geboorte aanwezig (congenitaal). Aangeboren aandoeningen zijn afwijkingen die ontstaan in de baarmoeder en waarmee het kind geboren wordt. Ze kunnen erfelijk zijn, maar ze kunnen ook ontstaan door invloeden van buitenaf, bijvoorbeeld door medicijn- of alcoholgebruik tijdens de zwangerschap, of door besmetting van de moeder met bijv. rode hond. Ook kan er sprake zijn van een combinatie van erfelijke en omgevingsfactoren (bijv. open ruggetje (spina bifida)).
Abductie is de buitenwaartse of zijwaartse beweging van een lichaamsdeel. Adductie is het tegenovergestelde van abductie en betekent dus te dicht bij elkaar.
Kortstondige bewustzijnsdaling als gevolg van een stoornis in de hersenen
Zuurvergiftiging. Bij acidose is er een toename van de zuurgraad in het bloed. Dit geeft een daling van de pH-waarde.
Adductie is de binnenwaartse beweging van een lichaamsdeel. Bij een adductiestand van bijvoorbeeld de benen bestaat er geen ruimte tussen de benen.
Abductie is het tegenovergestelde van adductie en betekent dus te gespreid.
Vijf enzymcomplexen die ingebed liggen in de binnenmembraan van het mitochondrion.
In het proces om energie te maken worden zuurstofmoleculen verbruikt zodat er gesproken kan worden over de 'ademhaling op celniveau'. De ademhalingsketen, of oxidatieve fosforylering, is het hart van de energiecentrale van het lichaam.
Afkorting van adenosinedifosfaat. Het energiearme product dat geproduceerd wordt wanneer ATP energie in de cel gebracht heeft.
Verworven taalstoornis ten gevolge van hersenletsel. Met spreekt van afasie als de taalstoornis ontstaat nadat de taalontwikkeling is afgerond. Een aangeboren taalstoornis wordt dysfasie genoemd.
Letterlijk: lopend. Een ambulante patiënt wordt niet in het ziekenhuis opgenomen maar heeft een kortdurend bezoek, bijvoorbeeld poliklinisch.
De bouwstenen van eiwitten
Het eerste gedeelte van een medisch onderzoek waarbij inlichtingen aan / over de patiënt gevraagd worden. De anamnese komt vooral tot stand door specifieke vragen van de arts. De anamnese omvat bijvoorbeeld:
* algemene gegevens, zoals naam, geboortedatum, beroep
* de ontwikkeling van de ziekte
* vroegere ziekten
* gegevens over de familie.
Anamnestisch verkregen informatie is informatie die de arts heeft verkregen door vragen aan de patiënt (ouders).
Het eerste gedeelte van een medisch onderzoek waarbij inlichtingen aan / over de patiënt gevraagd worden. De anamnese komt vooral tot stand door specifieke vragen van de arts. De anamnese omvat bijvoorbeeld:
* algemene gegevens, zoals naam, geboortedatum, beroep
* de ontwikkeling van de ziekte
* vroegere ziekten
* gegevens over de familie.
Anamnestisch verkregen informatie is informatie die de arts heeft verkregen door vragen aan de patiënt (ouders).
Zuurstoftekort in de weefsels
Medicatie tegen epilepsie. Wordt soms ook voorgeschreven bij zenuwklachten.
Middel tegen stuipen, toevallen (bij epilepsie). Synoniem: anticonvulsant.
Stof die oxidatie, dat is binding met zuurstof, tegengaat. Bepaalde vitamines (vit. E) zijn bijvoorbeeld antioxidanten.
Kort stoppen met ademen, ademstilstand, bijvoorbeeld in de slaap (slaapapnoe)
Stoornis in de samenwerking tussen de spieren, waardoor het verrichten van ordelijke bewegingen moeilijk wordt. Er zijn coördinatiestoornissen. Atactische bewegingen zijn onregelmatige, onbeheerste bewegingen.
Onophoudende, onwillekeurige, langzame buig- en strekbewegingen van vingers en tenen
Type epileptische aanval waarbij er geen verstijving van de spieren optreedt, maar juist een verslapping, waardoor de betrokkene plotseling bewusteloos neervalt.
Afkorting van adenosinetrifosfaat. De energie die via een groot aantal stofwisselingsstappen wordt vrijgemaakt en opgeslagen opdat de cel er iets mee kan.
ATP wordt gevormd uit ADP en fosfaat; dit proces heet oxidative phosphorylation (OXPHOS).
Verschrompeling van een orgaan door het afsterven van de cellen waaruit het orgaan bestaat.
Het afsterven wordt veroorzaakt door een tekort of juist een overmaat aan stoffen die de cel nodig heeft om te blijven leven.
Alleen voor de betrokkene waarneembare (=subjectieve) ervaringen, zoals het ruiken, zien, horen, proeven of voelen van iets, als voorbode van een epileptische aanval of migraine-aanval.
Het gedeelte van het zenuwstelsel dat de onwillekeurige organen (de buiten de wil om functionerende organen) verzorgt, zoals die van de spijsvertering, de bloedsomloop en de ademhaling.
Afwijkende voetzoolreflex, waarbij de grote teen bij het strijken onder de voetzool naar boven beweegt in plaats van naar onder. Deze afwijkende voetzoolreflex wijst op een stoornis in het zenuwstelsel.
BAEP staat voor Brain stem Auditory Evoked Potential. Dit is een test waarbij de zenuwgeleiding tussen oor en hersenen wordt onderzocht. Met een BAEP-test wordt de reactie van de hersenen gemeten op een prikkel van het gehoorsysteem. Doel is informatie te verkrijgen over de werking van de gehoorzenuw. Het onderzoek is niet pijnlijk en de patiënt hoeft zelf niets te doen.
Bij metabole ziekten is dat meestal de aanduiding voor onderzoek in bloed of urine, waarbij gekeken wordt naar afwijkende metabolieten (zie aldaar). Een afwijkende hoeveelheid van bepaalde stoffen kan aanleiding zijn voor verder gericht onderzoek, door middel van enzymdiagnostiek (zie aldaar) of gericht onderzoek in het DNA.
Het voorvoegsel brady- betekent langzaam of traag, bijvoorbeeld bradycardie: trage hartslag, bradyfrenie: mentale traagheid, vertraagd denken.
Een arts die gespecialiseerd is in het opsporen, diagnosticeren en behandelen van ziekten van het hart.
Aandoening van de hartspier
Carnitine (carnitene) is een aminozuur dat normaal in het eten voorkomt en door het lichaam gebruikt wordt voor het leveren van energie aan de skeletspieren. Carnitine is nodig voor het transport van vetzuren naar de mitochondriën zodat het vet kan worden verbrand. Daarnaast zou carnitine ook de membraan (wand) van de mitochondriën sterker maken.
Microscopisch klein onderdeel van alle planten, dieren en mensen. Het menselijk lichaam bestaat uit miljarden cellen.
Het centrale onderdeel van de cel waar het erfelijk materiaal, het DNA, in opgesloten zit. Vanuit de celkern vindt de aansturing van alle processen in de cel plaats.
De kleine hersenen betreffend
Een onderdeel van de hersenen, ook bekend als de kleine hersenen. De kleine hersenen hebben een belangrijke functie bij het sturen en regelen van bewegingen. De uiterlijk waarneembare verschijnselen van het niet goed functioneren van de kleine hersenen wordt ataxie (zie daar) genoemd.
Choreoathetose is een extrapiramidale stoornis. Mensen met deze bewegingsstoornis hebben een combinatie van twee bewegingsstoornissen: chorea en athetose. Chorea wordt gekenmerkt door onwillekeurige, schokkende, snelle bewegingen. Athetose wordt gekenmerkt door onwillekeurige, kronkelende bewegingen die langzamer zijn.
Drager van erfelijke eigenschappen. Het belangrijkste component is DNA. Alle chromosomen zitten samen in de celkern.
CK=creatine kinase. Door extreme spierarbeid kan er, door beschadiging van het vliesje om de spier heen, lekkage van weefselvocht uit de spieren ontstaan. Om de mate van lekkage uit spiervezels te meten kan de CK-waarde in het bloed gemeten worden. De CK-activiteit is bij veel, maar niet alle, spierziekten verhoogd. Zeer hoge waarden vindt men bijvoorbeeld bij spierdystrofie, normale waarden bij sommige aangeboren spierziekten. Als bij laboratoriumonderzoek een verhoogde CK-activiteit wordt gevonden, dan zal de bepaling in de regel herhaald worden om te kijken of de verhoging tijdelijk is en veroorzaakt wordt door een ongewoon sterkte inspanning.
Een abnormale beweging die gekarakteriseerd wordt door snelle aan- en ontspanning van spieren.
Een abnormale beweging die gekarakteriseerd wordt door snelle aan- en ontspanning van spieren.
Afkorting van Central Nervous System, de Engelstalige term voor het centraal zenuwstelsel.
Het denkvermogen. Het vermogen om alle informatie uit het dagelijks leven te interpreteren:
* oriëntatie in tijd, plaats en persoon
* aandacht en concentratie
* tempo van informatieverwerking
* geheugen
* schoolse vaardigheden
* redeneervermogen
* leervermogen
Met betrekking tot het denkproces
Aangeboren, reeds vanaf de geboorte aanwezig
Het in een gedwongen stand staan van een gewricht. Noch de patiënt zelf noch een ander kan die stand veranderen. Een contractuur kan ontstaan doordat de 'strekkers' ziek zijn en de 'buigers' gaan overheersen.
Een MRI of CT-scan 'met contrast' betekent dat er een contrastvloeistof ingespoten wordt.
Afkorting voor het Centraal ZenuwStelsel (hersenen en ruggenmerg)
Vermindering, afwezig zijn, niet functionerend
Benaming voor allerlei veranderingen in cellen en weefsels waardoor hun normale functie aangetast wordt. Een langzaam, geleidelijk proces van afsterven van bepaalde groepen (hersen)cellen.
Zie ook Atrofie.
Uitdroging, overmatig verlies van lichaamsvocht
Verslechteren, achteruitgaan
Dys- voor een woord betekent afwijkend.
Dysartrie is een spraakstoornis. De spieren die nodig zijn voor de stemgeving, het ademen en de uitspraak werken door een beschadiging van het zenuwstelsel onvoldoende. Omdat mensen met dysartrie moeilijk te verstaan zijn kan de communicatie problemen opleveren door bijvoorbeeld onduidelijke uitspraak, nasaal (door de neus) spreken of een combinatie hiervan.
Stoornis in het vermogen om woorden en zinnen te vormen, zonder dat het denkvermogen is aangetast.
Stoornis in de spierspanning door een fout in de coördinatie van de hersenen bij het bewegen. Hierdoor ontstaan continue samentrekkingen van de spieren waar de patiënt zelf geen invloed op kan uitoefenen.
Electro Cardiogram. Onderzoek naar de hart-activiteit. Er worden hiervoor plakkertjes op de borst geplaatst. Het onderzoek is pijnloos en kortdurend.
Electromyogram is een spier/zenuw onderzoek. Soms volledig pijnloos, soms onaangenaam door de schokjes en het plaatsen van kleine naaldjes.
Elektro-encefalogram. Registratie van de elektrische activiteit in de hersenen. Met lijm of een soort badmuts worden elektroden op het hoofd geplakt. Behalve ogen sluiten en openen hoeft de patiënt niets te doen. Het is een pijnloos onderzoek.
Huidverdovingsmiddel in de vorm van crème of pleister dat gebruikt kan worden als verdoving bij een injectie, plaatsen infuus, biopt of lumbaalpunctie.
Niet gedefinieerde ziekte in de hersenen.
Aandoening van de hersenen en de spieren.
Eiwit dat in ons lichaam wordt gemaakt door bepaalde aminozuren aan elkaar te knopen op basis van genetische informatie uit de celkernen.
Voor de diagnose van een stofwisselingsziekte is onderzoek in bloed of lichaamsweefsel noodzakelijk. Meestal wordt voor dat laatste een huidbiopt gebruikt, bij sommige aandoeningen, spier- of leverweefsel. Bij het enzym onderzoek worden de activiteiten van de verschillende enzymen op celniveau gemeten in een gespecialiseerd laboratorium. Enzymdiagnostiek komt in beeld als de behandelend arts bij een patient aanwijzingen vindt voor één of meer erfelijke metabole ziekte(n) met een bekend enzymdefect.
Een paramedische discipline die zich bezig houdt met onderzoek, begeleiding en behandeling van zo zelfstandig mogelijk functioneren.
* zelfverzorging, ADL activiteiten (zie aldaar), eten, drinken, wassen, aankleden, naar toilet gaan
* huishouden
* verplaatsen en vervoer
* vrije tijd / hobby's
* werk
* wonen
Meestal plotseling optredende verslechtering. Ook wel 'crash' genoemd.
Bij extrapiramidale bewegingsstoornissen is de aansturing van de spieren verstoord. Symptomen zijn bijv. spiertrekkingen in het gezicht, krampachtige strekkingen van het lichaam, trillende handen en abnormale onwillekeurige bewegingen die de normale bewegingen hinderen.
Het aangezicht betreffende.
Huidcellen. Kunnen onderzocht worden d.m.v. een huidbiopt.
De dragers van erfelijke eigenschappen die samen het DNA vormen. Genen bevatten het 'recept' voor het maken van eiwitten, waaronder enzymen.
Ander woord voor druivensuiker. De belangrijkste energiebron voor de cellen.
Glucosevoorraad in de lever.
Grote of grand mal : Een bepaald type epileptische aanval, die in twee fasen verloopt, namelijk eerst een tonische fase (waarin alle spieren secondelang verstijven en de ademhaling stokt) en vervolgens een clonische fase (waarin de spieren heftige ongecontroleerde bewegingen maken. Wordt ook wel grand mal-aanval of tonisch-clonische aanval genoemd.
Gezichtsveldverlies t.g.v. hersenletsel aan 1 of beide buitenkanten van het gezichtsveld.
Halfzijdige verlamming (arm + been + evt gezicht).
Het bloed betreffende.
Hyper- voor een woord staat voor te veel, overmatig.
Overmatige, ongewilde, ondoelmatige beweging.
Verhoogde reactie op prikkels. Te heftige reflex.
Grote afstand tussen b.v. de ogen.
Hoge bloeddruk.
Hypo- voor een woord staat voor te weinig, onvoldoende.
Hypoglykemisch, oftewel hypoglykemie, wil zeggen dat je een te laag gehalte aan bloedsuiker (glucose) hebt. Je kunt dan last hebben van de volgende verschijnselen: zweten, trillen, angst, hartkloppingen, je kunt je niet meer concentreren, verwarring, vermoeidheid, moeite met spreken, slapte, hoofdpijn, misselijkheid, wazig zien.
Hypoglykemisch, oftewel hypoglykemie, wil zeggen dat je een te laag gehalte aan bloedsuiker (glucose) hebt. Je kunt dan last hebben van de volgende verschijnselen: zweten, trillen, angst, hartkloppingen, je kunt je niet meer concentreren, verwarring, vermoeidheid, moeite met spreken, slapte, hoofdpijn, misselijkheid, wazig zien.
Lage bloeddruk.
Het steeds erger trillen van een ledemaat, naar gelang het doel dichterbij komt.
Toediening van een geneesmiddel per injectie in een spier.
Toediening van een geneesmiddel per injectie in een ader.
Dieet gekenmerkt door voeding met een hoog vetgehalte en een laag koolhydraat- en eiwitgehalte. Door dit dieet mist het lichaam de koolhydraten en moet het op zoek naar een andere energiebron: Het schakelt over op vetverbranding. Kan worden toegepast bij anders slecht behandelbare epilepsie en bij sommige stofwisselingsziekten als alternatieve energiebron.
Een arts gespecialiseerd in de erfelijkheid van ziekten.
Melkzuur.
Regelcentrum in de hersenen dat informatie vanuit al onze zintuigen krijgt en verwerkt en verder betrokken is bij geheugen, gedrag en emoties.
Het vocht in de hersenen en het ruggenmerg . Afwijkingen in het liquor (afgetapt m.b.v. LP =Lumbaalpunctie) wijzen op een encephalopathie. Het soort afwijkingen kan richting geven aan het vinden van een diagnose.
Een paramedische discipline die zich bezig houdt met het onderzoeken, begeleiden en behandelen van alles dat met communicatie te maken heeft:
* primaire mondfuncties (zie aldaar)
* spraak
* taal
* gehoor
Door middel van een prik tussen de ruggenwervels wordt vocht afgetapt dat zich in het ruggenmerg bevindt. Dit vocht, ook wel liquor genoemd, wordt onderzocht. De uitslag van dit onderzoek kan helpen een diagnose te stellen. Na de prik kun je hoofdpijn hebben of duizelig zijn. Dit gaat meestal vanzelf weer over. Plat blijven liggen en veel drinken helpt. Als er na 5 dagen nog hoofdpijn bestaat contact opnemen met de arts.
De tussen- of eindproducten die ontstaan nadat een chemische stof in een biologisch systeem (bacteriën, planten ,dieren en mensen) metabolisme heeft ondergaan. Metabolieten zijn onder andere : de aminozuren, adenosinetrifosfaat of ATP, glucose, adrenaline enz.
Stofwisseling.
Alle biochemische reacties die plaats vinden in het lichaam. Al deze reacties samen zorgen voor de energie die het lichaam nodig heeft voor de lichaamsfuncties zoals ademhaling, denken en bewegen.
Stofwisselings (metabole) ziekte. Veroorzaakt door een fout in 1 van de vele stappen (reacties) in de stofwisseling. In de mitochondria vinden meer dan 100 verschillende stofwisselingsstappen plaats.
Een heel belangrijke functie van de mitochondria is de rol als energie-centrale in de cel. Hoewel de mitochondria veel meer functies hebben wordt met een mitochondriële aandoening vrijwel altijd een energie-ziekte bedoeld.
Mitochondriële aandoeningen kunnen op verschillende manieren ingedeeld worden.
* Naar het complex dat niet goed werkt (deficiënt is):
Complex 1, 2, 3, 4, 5 deficiëntie. Sommige deficiënties komen vaker voor dan andere (complex 1 en 4). Vaak komen er ook meer deficiënties tegelijk voor ( bijv. complex 1 + 4)
* Naar de aard van de klachten, in een syndroom (bijv. Leigh-, MERFF-, MELAS-, Kearns-Sayre-, LHON- Pearsons's en NARP syndroom).
Stofwisselings (metabole) ziekte. Veroorzaakt door een fout in 1 van de vele stappen (reacties) in de stofwisseling. In de mitochondria vinden meer dan 100 verschillende stofwisselingsstappen plaats.
Een heel belangrijke functie van de mitochondria is de rol als energie-centrale in de cel. Hoewel de mitochondria veel meer functies hebben wordt met een mitochondriële aandoening vrijwel altijd een energie-ziekte bedoeld.
Mitochondriële aandoeningen kunnen op verschillende manieren ingedeeld worden.
* Naar het complex dat niet goed werkt (deficiënt is):
Complex 1, 2, 3, 4, 5 deficiëntie. Sommige deficiënties komen vaker voor dan andere (complex 1 en 4). Vaak komen er ook meer deficiënties tegelijk voor ( bijv. complex 1 + 4)
* Naar de aard van de klachten, in een syndroom (bijv. Leigh-, MERFF-, MELAS-, Kearns-Sayre-, LHON- Pearsons's en NARP syndroom).
Het gedeelte van de cel dat verantwoordelijk is voor de omzetting van allerlei stoffen in energie. Mitochondriën worden ook wel de energiecentrales van het lichaam genoemd.
Meervoud: Mitochondriën of mitochondria.
Beweging. Wat met bewegen te maken heeft (zitten, staan, lopen,… schrijven, tekenen,…).
Beweging. Wat met bewegen te maken heeft (zitten, staan, lopen,… schrijven, tekenen,…).
Iemand met een genetische aandoening kan zowel normale als abnormale cellen hebben. Dan zit de fout dus niet in alle cellen. De klachten van de ziekte zijn dan minder of minder erg of kunnen zelfs ontbreken. Dit noemen we mozaïekvorm of mozaïcisme.
Iemand met een genetische aandoening kan zowel normale als abnormale cellen hebben. Dan zit de fout dus niet in alle cellen. De klachten van de ziekte zijn dan minder of minder erg of kunnen zelfs ontbreken. Dit noemen we mozaïekvorm of mozaïcisme.
Magnetic Resonance Imaging. Dit onderzoek is te vergelijken met de CT-scan. Je ligt hierbij in een tunnel. Er worden opnamen gemaakt van de hersenen of het ruggenmerg. Het apparaat, waar je met je hoofd inligt, kan deze opnamen maken door middel van het veranderen van magnetische velden. Er worden geen röntgenstralen maar radiogolven gebruikt. De opnamen van hersenen en ruggenmerg zijn van uitzonderlijk goede kwaliteit. Omdat er gebruik gemaakt wordt van magnetische golven mag je geen voorwerpen van ijzer dragen of andere voorwerpen die het magnetisch veld kunnen verstoren. Tijdens het onderzoek is een hard getik hoorbaar. Je kunt oordoppen dragen of een bandje met favoriete muziek meenemen en beluisteren. Bij kinderen wordt veelal een lichte narcose gegeven omdat het onderzoek langdurig stilliggen vereist. Soms wordt contrastvloeistof ingespoten. Het onderzoek is ongevaarlijk en een belangrijk middel om een diagnose te kunnen stellen. Idem: NMR, Nuclear Magnetic Resonance
Een onderzoeks- of behandelteam dat bestaat uit meerdere specialisten / specialisaties die samen werken. Een revalidatie-team is multidisciplinair. Naast de revalidatiearts kunnen o.a. de fysiotherapie, ergotherapie,logopedie maatschappelijk werk, psychologie, diëtist, verpleegkundige deel uit maken van een dergelijk team.
Spier.
Een musculaire aandoening is een aandoening van de spieren (myopathie).
Een verandering in het genetisch materiaal. Zowel in het DNA als in de genen.
Spierpijn.
Witte stof.
Vetachtige cellen die een isolatielaag vormen rondom zenuwcellen. Deze laag maakt het mogelijk de elektrische signalen die de cel verzendt, sneller te vervoeren. Bij de geboorte is myeline nauwelijks aanwezig. In de ontwikkeling naar volwassenen wordt het stapsgewijs aangemaakt.
Myo- (grieks) is spier.
Wanneer en voor een woord MYO staat, dan betekent het dat het de spieren betreft.
Willekeurige, snelle spierschokken met kortdurend bewegingseffect. Niet alle myoclonieën zijn epileptisch en ze kunnen bij vele aandoeningen voorkomen.
Type epileptische aanval waarbij enkelvoudige of in reeksen voorkomende spierschokken optreden in de armen en/of de benen, met een zeer kortdurende bewustzijnsstoornis. Het kan een voorbode zijn van een volledige epileptische aanval (zie Tonisch-clonische aanval).
Iedere abnormale conditie of ziekte van het spierweefsel. Kan zowel de skeletspieren als hartspier betreffen.
Bij myotonie ontspannen aangespannen spieren te langzaam ten gevolge van problemen in de spier- of zenuwcellen. Iemand met myotonie heeft bijvoorbeeld moeite met het loslaten van een voorwerp dat hij eerder vast had. Het gevoel wordt wel omschreven als 'stijfheid'.
Het afsterven van zenuwcellen in het netvlies, waardoor het gezichtsvermogen slechter wordt: Men ziet waziger, niet meer geheel scherp.
Zenuwpijn.
Zenuwontsteking.
Met betrekking tot de zenuwen en / of hersenen.
De zenuwen en spieren betreffende.
Ziekte van de zenuwen.
Een verzameling van uiteenlopende stoffen die zorg dragen voor en/of informatie doorgeven van de ene zenuwcel naar de andere of van zenuwcellen naar klieren, spieren, zintuigcellen en terug.
met betrekking tot de hersenen, het ruggemerg en een onderdeel van het zenuwstelsel dat zelfstandig (buiten de wil om) zorgt voor het aansturen van verschillende organen
met betrekking tot de hersenen, het ruggemerg en een onderdeel van het zenuwstelsel dat zelfstandig (buiten de wil om) zorgt voor het aansturen van verschillende organen
Nuclear Magnetic Resonance. Zie MRI
Het onderzoek waarbij oogbewegingen worden geregistreerd.
Onwillekeurige, snelle, ritmische bewegingen (trillen) van het oog, meestal horizontaal. Kan aanwijzing zijn voor aandoening in evenwichtsorgaan.
Registratie van de oogbewegingen.
Zie ook nystagmografie.
Oogspierverlamming.
Onderdelen van de cel. De celkern is een van de organellen. Daarnaast zijn bekend: lysosomen, peroxisomen, mitochondriën, het Golgiapparaat enzovoort.
Het gehoor, het oor betreffende.
Oxidatieve Phosphorylering.
De omzetting van energie verkregen uit de verbranding van suikers en vetten tot lichaamseigen energie ter hoogte van de ademhalingsketen in de celkern.
Niet pijnlijke gevoelens die niet worden veroorzaakt door een passende uitwendige prikkel. Ook wel sensibiliteitsstoornissen genoemd. Bijvoorbeeld prikkelen, tintelen of een bandengevoel.
Volledig krachtsverlies.
Verlamming aan beide benen.
Krachtsvermindering. Aanduiding van de mate van verlamming.
Pathie (grieks) betekent ziekte, afwijking, aandoening. Pathie komt achter datgene dat afwijkend is. Myo-pathie betekent een aandoening van de spieren. Neuro-pathie betekent een aandoening van de zenuwen. Pathologisch is door een ziekte veroorzaakt.
Door een ziekte veroorzaakt.
Gezichtsveld-onderzoek.
Persoonlijkheid is het geheel van kenmerken van iemands gedrag en heeft altijd een relatie met de buitenwereld. Elementen die samen de persoonlijkheid vormen:* basisstemming
* zelfbeeld en vertrouwen
* impulscontrole
* evaluatie van eigen gedrag
* inzicht in en acceptatie van stoornissen en mogelijkheden
* oordeelsvermogen
* sociaal gedrag
* persoonlijkheidsstoornissen.
Positron Emissie Tomografie. Techniek om een beeld van de hersenen krijgen. Door een combinatie van twee methoden geeft de functie onder andere bloeddoorstroming, zuurstof- en glucoseverbruik in de hersenen en de werking van de hersenen weer, wordt ook gebruikt om epileptische haarden op te sporen.
Voor de geboorte.
Specialisatie binnen de logopedie die zich bezig houdt met mondfuncties voordat de spraak / taal op gang gekomen is (bijvoorbeeld zuigen, slikken, kauwen).
Voorspelling omtrent het verdere verloop.
Toenemend in ernst.
Psychische gevolgen van een ziekte kunnen de
* cognitie
* intelligentie
* persoonlijkheid en gedrag betreffen.
Intelligentie = kennis- en begripsvermogen. Cognitie = denkvermogen.
Intelligentie en cognitie zijn noodzakelijk om te kunnen leren en vormen de basis voor adequaat gedrag.
Hangend ooglid.
Druivenzuur.
Verlamming aan benen en armen.
Geestelijke achterstand.
Netvlies. Het vlies dat de binnenvlakte van het oog bekleedt en waarop het beeld van de waargenomen voorwerpen wordt gevormd. Netvliesdegeneratie: Het afsterven van zenuwcellen in het netvlies, waardoor het gezichtsvermogen slechter wordt: Men ziet waziger, niet meer geheel scherp.
Erfelijke aandoening van het netvlies (ogen).
Achter.
Behandelonderdeel van (onder andere) neuromusculaire aandoeningen. Bij progressieve achteruitgaande)aandoeningen gericht op voorkoming van het verlies van onafhankelijkheid en kwaliteit van bestaan.
De behandelaars die betrokken kunnen zijn bij de revalidatie. Revalidatie-arts, stelt een revalidatie-diagnose en een revalidatie-plan -doel. Coördineert de verschillende therapieën en andere bij de patient betrokken specialisten(case-management). Verder kunnen van het team deel uit maken: De fysiotherapeut, ergotherapeut, logopedist, maatschappelijk werker, psycholoog, orthopedagoog, orthopedisch schoen- en/of instrumentenmaker, diëtist, verpleegkundige, muziektherapeut. De huisarts maakt geen deel uit van het revalidatieteam, maar dient wel op de hoogte gehouden worden door de revalidatiearts. De revalidatiearts dient het aanspreekpunt voor de huisarts te zijn.
Verkromming van de wervelkolom.
Kalmerend, rustgevend medicijn.
Met het lichaam te maken hebbende. Somatische gevolgen van een ziekte kunnen
* motorisch,
* vegetatief,
* neurologisch,
* orthopedisch en
* sensorisch zijn.
Motorisch = beweging; vegetatief = basale lichaamsprocessen; neurologisch = zenuwstelsel; orthopedisch = botten en gewrichten; sensorisch = waarneming.
Verlamming die gepaard gaat met een verhoogde spierspanning (tonus, hypertonie).
Somato-sensory evoked potentials. Bij dit onderzoek worden de zenuwbanen onderzocht die het gevoel voorgeleiden. Hiervoor worden elektrische prikkels op scheenbeen of pols toegediend.
Processen in het lichaam waarbij in de cel de ene stof wordt omgezet in de andere.
Ook: metabole ziekte. Door gebrek aan een bepaald enzym of activator van een enzym treedt een stoornis in het geheel van biochemische reacties die het lichaam aansturen. De plaats, aanwezigheid van restactiviteit, en de functie van het deficiënte enzym bepalen de gevolgen voor het lichaam en dus de symptomen van de ziekte die ontstaat.
Scheelzien.
Een combinatie van verschillende klachten / symptomen die gezamenlijk een ziektebeeld vormen.
Transcutane Electro Neuro Stimulatie. Een klein toestelletje (krachtbron) dat door middel van electroden en klevers wordt verbonden met de pijn-zone. De pijngewaarwording wordt verminderd door elektrische stimulatie (tinteling). Het TENS-toestelletje wordt eerst in bruikleen gegeven om te worden uitgeprobeerd. Blijkt het voor u een doeltreffende pijnbestrijder, dan kan het worden aangekocht.
Snel. Bijvoorbeeld tachyardie: snelle hartslag.
Een veelvoorkomend type epileptische aanval (temporaal epilepsie),waarbij de patiënt doelloze bewegingen uitvoert, een starende blik heeft en gedeeltelijk (of geheel ) het bewustzijn verliest. Vaak gaan aan de aanval bepaalde gevoelens vooraf (zie ook Aura). Dit type aanval werd vroeger ook wel 'petit mal aanval' of 'psychomotorische aanval' genoemd.
Een veelvoorkomend type epileptische aanval (temporaal epilepsie),waarbij de patiënt doelloze bewegingen uitvoert, een starende blik heeft en gedeeltelijk (of geheel ) het bewustzijn verliest. Vaak gaan aan de aanval bepaalde gevoelens vooraf (zie ook Aura). Dit type aanval werd vroeger ook wel 'petit mal aanval' of 'psychomotorische aanval' genoemd.
Bij tetraplegie, of quadriplegie, zijn alle vier de ledematen verminderd krachtig. Het kan gaan om een slappe of een spastische krachtsvermindering.
De thalamus verbindt (en filtert prikkels tussen) het ruggenmerg en de grote hersenen. Het is een schakelstation voor impulsen uit de zintuigen, behalve de reuk. Als je geconcentreerd met iets bezig bent, kan de thalamus ervoor zorgen dat je je minder bewust bent van andere impulsen. Ook reguleert de thalamus de slaap.
De tonus is de spanningstoestand van een spier. De tonus kan abnormaal verhoogd zijn (hypertonie). Dit leidt bijvoorbeeld tot spasmen. De tonus kan abnormaal verlaagd zijn (hypotonie). Dit leidt bijvoorbeeld tot een slappe verlamming waarbij de patiënt een lichaamsdeel niet in een bepaalde stand kan houden.
Bevingen bij het maken van willekeurige bewegingen. Intentietremor: het steeds erger trillen van een ledemaat, naar gelang het doel dichterbij komt.
Visual evoked potentials. Bij dit onderzoek worden de zenuwverbindingen tussen het oog en de hersenen onderzocht. Er wordt een elektrode op het hoofd geplakt en de patiënt krijgt een zwart-wit geblokt bord of lichtflitsen te zien. De patiënt hoeft niets te doen en het onderzoek is niet pijnlijk. Gemeten wordt de tijd die het duurt voor de hersenen reageren op de prikkels.
Duizeligheid.
Het zien, de ogen betreffende.
Het zien, de ogen betreffende.
Wet Maatschappelijke Ondersteuning. Opvolger van WVG = Wet Voorzieningen Gehandicapten.












